上海微系统所在肿瘤声动力治疗方面取得进展
作为一种新兴的非侵入性肿瘤治疗手段,声动力治疗(SDT)技术在近年来发展迅速。较之于现有的光动力治疗技术,SDT技术具有更好的组织穿透能力,因此其在肿瘤治疗领域具有更大的优势。超声作用下的声热、声空化和声化学过程是公认的SDT过程对肿瘤细胞杀灭的主要机制。其中,声敏剂参与下的声化学过程在SDT过程中起着至关重要的作用。因此,开发具有高声敏活性的新型声敏剂是摆在SDT技术面前的一项重要挑战。
中国科学院上海微系统与信息技术研究所丁古巧团队与上海交通大学医学院附属新华医院段俊丽团队、中山医院石一沁博士合作,首次证实N掺杂石墨烯量子点(N-GQDs)的优异声敏活性。N-GQDs在超声辐照下的活性氧(ROS:单线态氧及羟基自由基)的生成效率为传统声敏剂的3-5倍(图1a)。更重要的是,该工作首次明确了N掺杂碳纳米结构的声化学机制。实验结果与理论结果表明,N-GQDs中的吡咯N和吡啶N是其声化学过程的反应位点。上述机制的明确对高性能碳基声敏剂的进一步结构设计具有重要借鉴意义。此外,由于石墨烯量子点晶格中吡咯N和吡啶N的稳定性,N-GQDs在进行肿瘤靶向修饰后(FA-N-GQDs)仍具有优异的声敏活性。
进一步的组学结果表明,超声下FA-N-GQDs产生的大量ROS可使高p53蛋白表达的肿瘤细胞中氧化应激反应通过PEX通路被激活,进而通过p53蛋白促使肿瘤细胞凋亡(图1b)。细胞实验表明,FA-N-GQDs参与下的SDT过程对各肿瘤细胞的杀灭效率均大于95%。此外,小鼠皮下瘤模型治疗结果表明,经由靶向修饰的FA-N-GQDs可快速稳定地富集于肿瘤组织,在14天内进行两次超声辐照后,瘤体减小95%以上(图1c)。同时,基于FA-N-GQDs优异的稳定性及生物安全性,治疗过程中未发现显著的毒副作用。
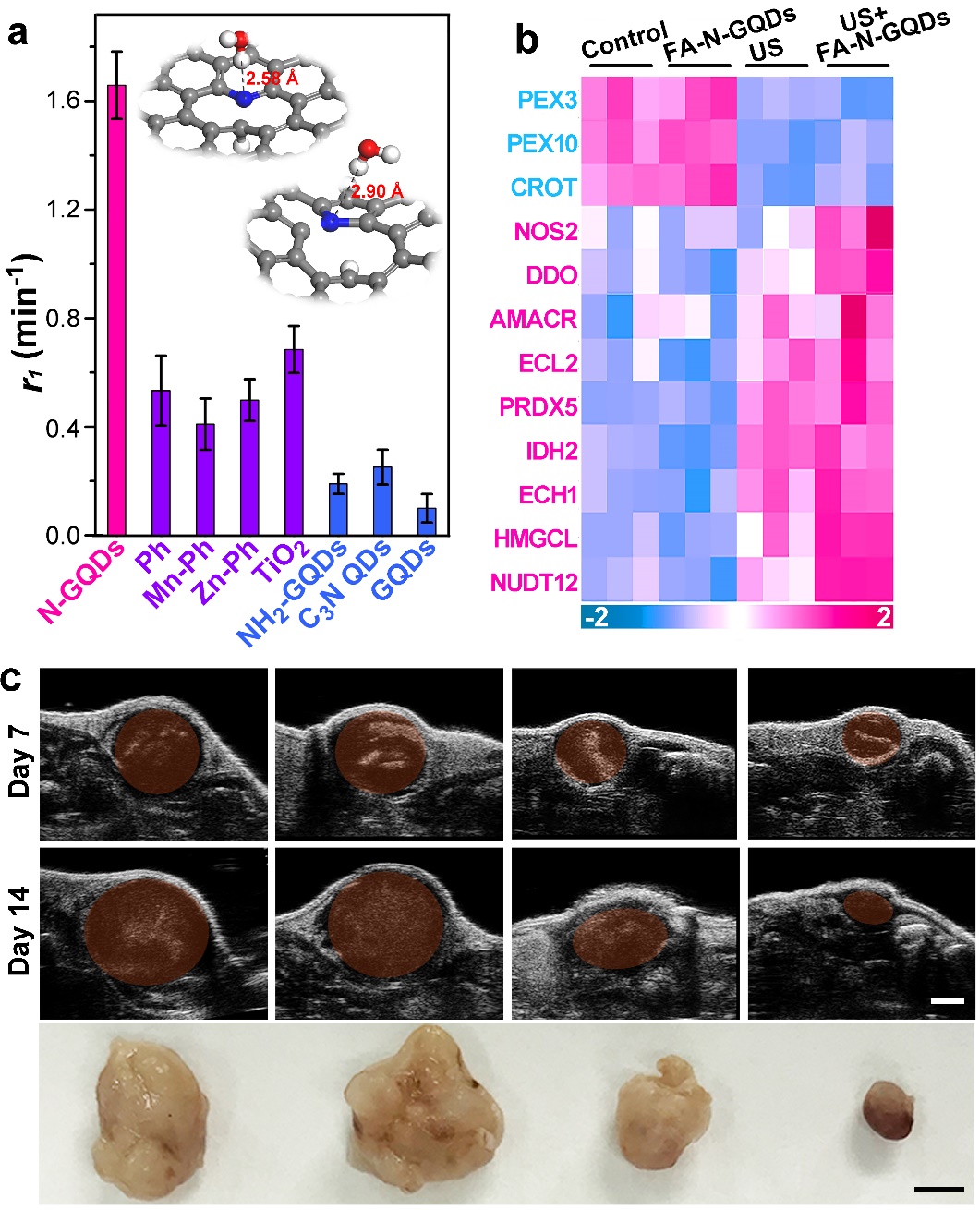
图1. (a)N-GQDs声化学效率与传统声敏剂对比。(b) 高p53蛋白表达的肿瘤细胞在FA-N-GQDs参与下超声处理后的组学结果。(c) FA-N-GQDs参与下SDT过程中小鼠皮下瘤尺寸变化。
上述工作不仅是石墨烯量子点在SDT领域的首次应用探索研究,同时揭示了碳纳米结构中吡咯N和吡啶N作为声化学反应中心在SDT过程中的作用机制,对高性能声敏剂,特别是无金属碳基声敏剂的开发具有指导意义。相关研究成果近期以“Graphene Quantum Dots with Pyrrole N and Pyridine N: Superior Reactive Oxygen Species Generation Efficiency for Metal-free Sonodynamic Tumor Therapy”为题在线发表于Small (IF=11.459)。论文第一作者为中科院上海微系统所助理研究员杨思维博士,共同第一作者为上海交通大学医学院附属新华医院王雪连博士,通讯作者为中科院上海微系统所丁古巧研究员、中山医院石一沁博士。相关工作得到国家自然科学基金(11804353, 11774368)、上海市科委项目(18511110600)等资金支持。
原文链接: https://onlinelibrary.wiley.com/doi/full/10.1002/smll.202004867