超灵敏电化学传感芯片立体探测神经胞吐作用
神经递质通过胞吐作用进行释放是神经生物学、生物化学、临床医学和病理学等许多领域的基本生化事件。测试胞吐作用可以为帕金森病等精神疾病的药物治疗提供重要的分子作用基础。此外,许多常用药物(如抗病毒药物和止痛药物等)也可能影响神经细胞的胞吐作用。但由于神经细胞的胞吐作用测量目前主要依赖于碳纤维电极(CFE)等精密测量仪器以及专业的实验操作技能,制约了药物对神经细胞胞吐作用的调控研究。因此,亟需发展先进的测量方法来直接、便捷、高效测量神经细胞的胞吐作用,进而加速研究药物对神经系统的影响。
近日,中科院上海微系统所许鹏程和李昕欣研究团队在Nano Letters上报道了一种具有多维协同纳米敏感效应的电化学传感器,可以对神经细胞的胞吐作用进行直接、实时检测,为神经生物学等多学科提供了一种新的研究方法。相关研究研究成果于2023年3月22日以“Functionally Collaborative Nanostructure for Direct Monitoring of Neurotransmitter Exocytosis in Living Cells”为题发表在当期的Nano Letters上(Nano Lett. 2023, 23, 6, 2427–2435)。
针对神经细胞胞吐的直接检测,李昕欣研究团队发明并使用一种具有协同效应的多维复合纳米材料(MNG-1)作为电化学敏感材料,将其负载在丝网印刷电极上制成可抛弃式电化学传感芯片。传统的电化学传感器主要用于测试均匀溶液中的多巴胺分子,现已有大量的文献报道。而李昕欣研究团队报道的电化学传感器使用了高灵敏的MNG-1敏感材料,可将神经递质多巴胺(DA)直接深度催化氧化成聚多巴胺(PDA),对DA的检测下限优于1pM。尤其是该敏感材料具有阵列式“天线状”结构,在具有超灵敏度的同时,还具有时空分辨率,可以对单细胞直至数十个细胞的胞吐作用进行同时检测,因而可快速、方便地获取到具有多细胞统计学意义的胞吐数据。该方法无需在显微镜下进行高难度的单细胞封接操作,也不需要贴壁生长的细胞,只需将细胞分散液用普通的移液器滴加于传感芯片上即可直接进行测试,耗时短。该测试仅需要使用实验室中普通的电化学工作站,不再需要膜片钳等操作难度非常高的昂贵大型仪器。
在本项研究中,选取了5种曾用的抗新冠病毒药物,包括克力芝(洛匹那韦/利托那韦)、利巴韦林、羟氯喹(HCQ)、阿比朵尔和地塞米松(DXM)作为研究目标,分别测试了其对胞吐作用的影响。研究结果显示,克立芝和地塞米松可以明显增强神经细胞的胞吐作用;羟氯喹和利巴韦林则大幅抑制了胞吐作用,而阿比朵尔对胞吐作用没有明显影响。除了上述抗新冠病毒药物,该研究还进一步发现奥司他韦和布洛芬等药物对胞吐都具有明显的增强作用。该电化学传感器不仅可以推进基础神经科学研究,还可推动药物的神经作用研究,在多领域都展示出令人期待的应用潜力。
中科院上海微系统所许鹏程研究员为文章的第一作者,许鹏程研究员、李昕欣研究员为共同通讯作者。该研究工作获得了科技部国家重点研发计划项目和国家自然科学基金等项目的支持。
论文链接:https://pubs.acs.org/doi/10.1021/acs.nanolett.2c04117
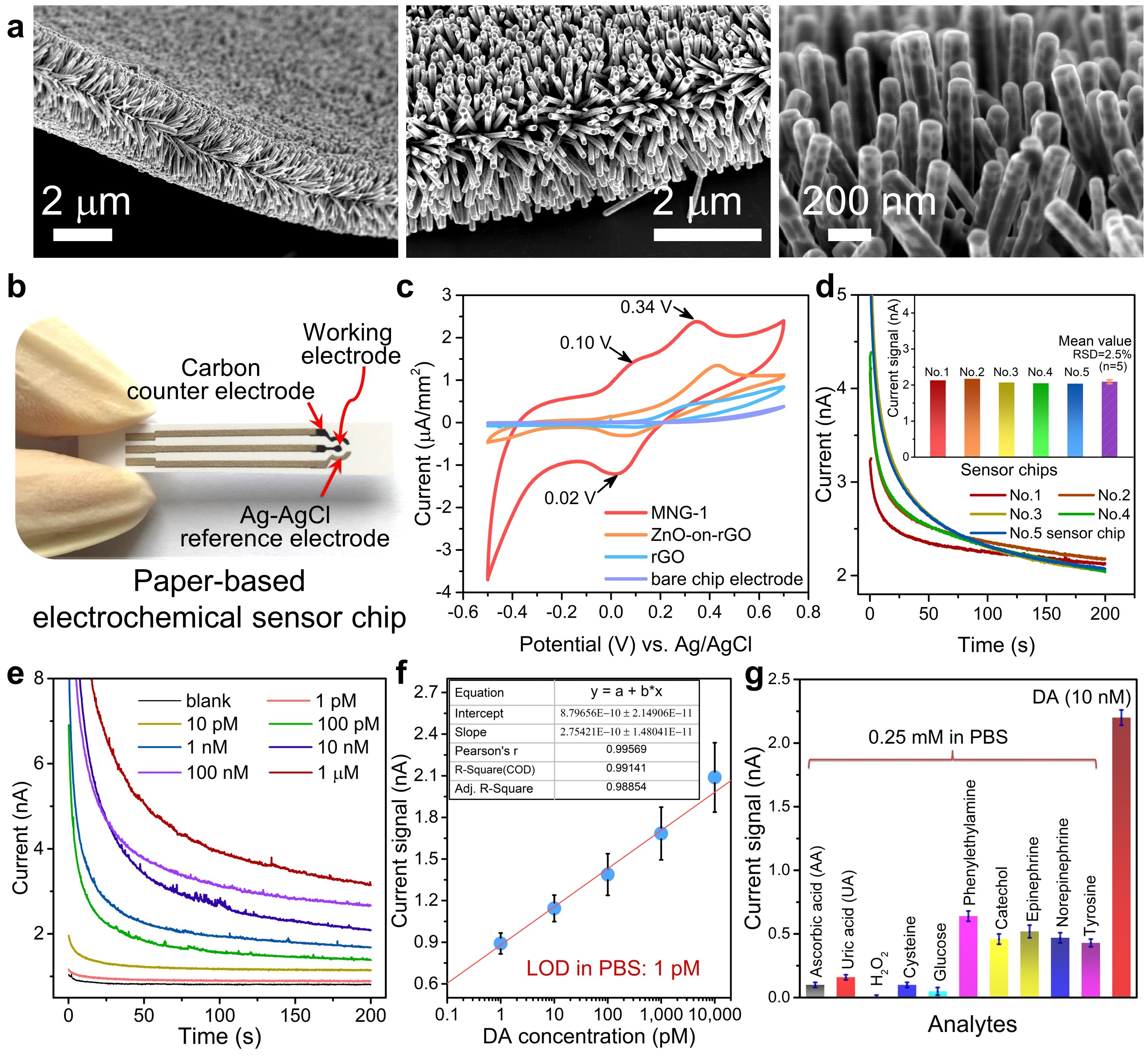
图1. 多维协同纳米敏感材料(MNG-1)对多巴胺(DA)分子的电化学敏感性能。MNG-1纳米材料具有阵列式“天线状”三维立体形貌。该传感器对DA的检测下限(LOD)优于1pM。
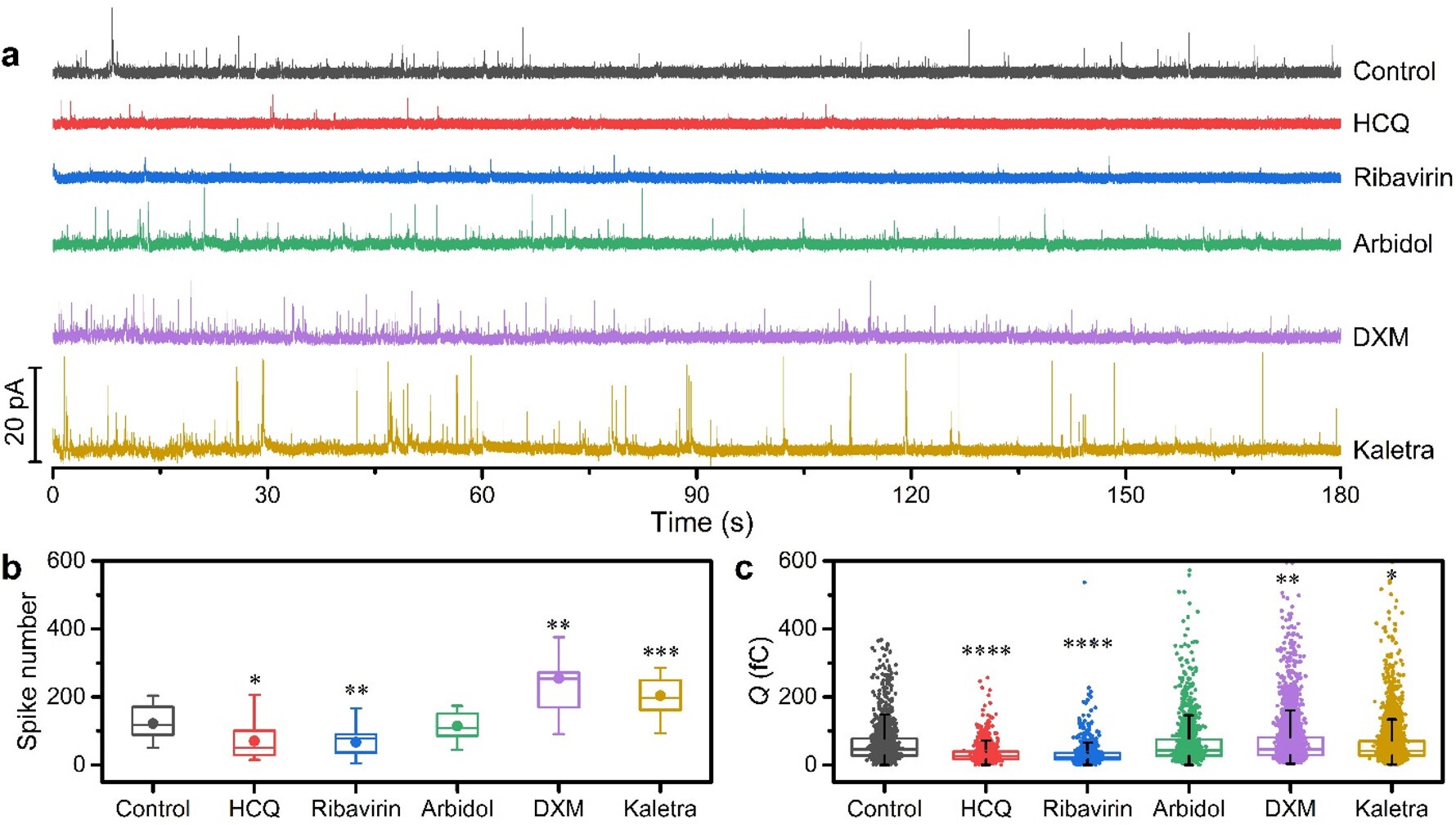
图2. 五种抗冠状病毒药物对胞吐作用的影响结果。测试图谱中的不连续尖峰即是由胞吐事件引起的传感检测信号。